Agencia Europea del Medicamento
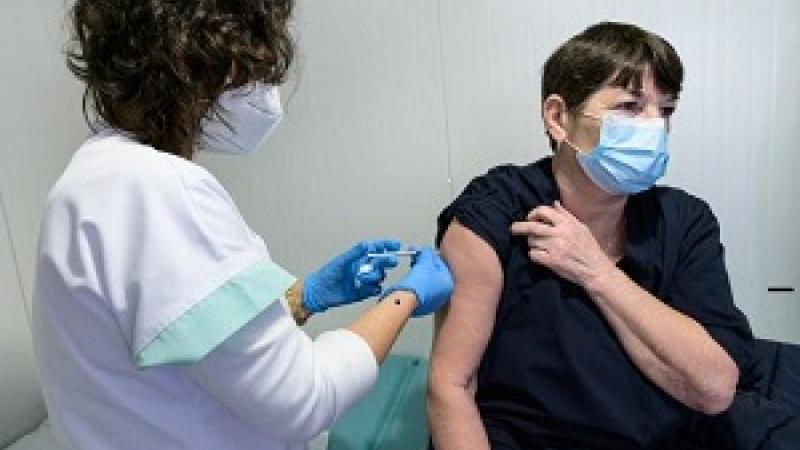
La EMA recibe la solicitud de autorización de comercialización de Regkirona (regdanvimab) para el tratamiento de pacientes con COVID-19
La EMA ha comenzado a evaluar una solicitud de autorización de comercialización para el anticuerpo monoclonal Regkirona (regdanvimab, también conocido como CT-P59) para tratar a adultos con COVID-19 que no requieren oxigenoterapia suplementaria y que tienen un mayor riesgo de progresar a COVID 19 grave. El solicitante es Celltrion Healthcare Hungary Kft.
La EMA evaluará los beneficios y riesgos de Regkirona en un plazo reducido y podría emitir una opinión en un plazo de dos meses, según la solidez de los datos presentados y si se requiere más información para respaldar la evaluación.
Un período de tiempo tan corto solo es posible porque el comité de medicamentos humanos (CHMP) de la EMA ya ha revisado algunos datos sobre el medicamento durante una revisión continua. Durante esta fase, el CHMP evaluó los datos de los estudios de laboratorio y los estudios en animales, así como los datos sobre la calidad del medicamento. Además, el CHMP evaluó los datos de un estudio sobre los efectos de Regkirona en pacientes ambulatorios adultos con síntomas de COVID-19 de leves a moderados que no necesitan oxígeno suplementario.
Fuente: EMA